Bahan Kimia dan Reaksinya
Kimia adalah bidang ilmu yang mempelajari tentang zat, sifat, dan reaksi antarzat dalam semua makhluk hidup dan alam semesta. Bahan kimia adalah zat-zat yang terlibat dalam suatu reaksi kimia. Pada umumnya bahan kimia terdiri dari unsur atau senyawa kimia. Sementara reaksi kimia adalah perubahan dari zat-zat tersebut yang terjadi secara kimiawi.
Dalam pembelajaran kimia pada kelas 12 semester 1, kalian akan mempelajari materi tentang bahan kimia dan reaksinya. Di bawah ini terdapat beberapa contoh soal kimia kelas 12 semester 1 beserta jawabannya yang berkaitan dengan bahan kimia dan reaksinya:
Contoh Soal 1:
Sebuah eksperimen dilakukan dengan mencampurkan 10 gram zink dengan 5 gram asam klorida. Apa yang terjadi pada kaleng bekas kornet tersebut setelah dicampurkan?
Jawaban:
Setelah bahan tersebut dicampurkan, terjadi suatu reaksi kimia antara zink dan asam klorida. Reaksi ini disebut reaksi pengganti. Zink bereaksi dengan asam klorida dan menghasilkan gas hidrogen (H2) dan garam zink klorida (ZnCl2). Reaksi kimia tersebut dapat ditulis sebagai:
Zn + 2HCl → ZnCl2 + H2
Kaleng bekas kornet tersebut akan mengeluarkan gas hidrogen dan garam zink klorida. Gas hidrogen akan membentuk gelembung-gelembung kecil di dalam larutan tersebut.
Contoh Soal 2:
Sebuah unsur X bereaksi dengan oksigen untuk membentuk senyawa X2O3. Jika 10 gram unsur X bereaksi dengan 9 gram oksigen, maka berapakah massa X2O3 yang terbentuk?
Jawaban:
Berikut adalah langkah-langkah penyelesaian:
1. Tentukan jenis reaksi yang terjadi.
Unsur X bereaksi dengan oksigen untuk membentuk senyawa X2O3. Reaksi yang terjadi adalah reaksi pelepasan (dekomposisi).
2. Tuliskan rumus reaksi kimia yang terjadi.
X + O2 → X2O3
3. Tentukan jumlah mol yang terlibat dalam reaksi.
Massa X: 10 gram
Massa O2: 9 gram
Molar massa X: 40 g/mol
Molar massa O2: 32 g/mol
Mol X: 10 g / 40 g/mol = 0,25 mol
Mol O2: 9 g / 32 g/mol = 0,28 mol
4. Tentukan stoikiometri (hubungan antara mol unsur dan mol senyawa yang terbentuk).
Berdasarkan rumus reaksi, hubungan antara mol X dan X2O3 adalah 1:1.
5. Tentukan massa X2O3 yang terbentuk.
Mol X2O3 yang terbentuk juga 0,25 mol berdasarkan stoikiometri yang telah ditentukan.
Massa molar X2O3: 2×40 g/mol + 3×16 g/mol = 106 g/mol
Massa X2O3 yang terbentuk: 0,25 mol x 106 g/mol = 26,5 gram
Itulah beberapa contoh soal kimia kelas 12 semester 1 beserta jawabannya yang berkaitan dengan bahan kimia dan reaksinya. Semoga dapat membantu kalian dalam mempelajari materi ini dengan lebih mudah.
Sifat Koligatif Larutan
Koligatif berasal dari kata koli yang berarti jumlah. Dalam kimia larutan, sifat koligatif adalah sifat dari larutan yang bergantung pada jumlah partikel di dalamnya, bukan pada jenis partikel itu sendiri. Sifat koligatif larutan dilandaskan pada hukum Raoult dan kenaikan tekanan uap normal. Dalam pembahasan ini, akan dijelaskan tentang jenis-jenis sifat koligatif larutan beserta contohnya.
1. Tonus Molal (Teori Osmotik van’t Hoff)
Tonus molal adalah salah satu sifat koligatif larutan yang menunjukkan besarnya konsentrasi zat terlarut di dalam suatu larutan. Tonus molal didefinisikan sebagai jumlah gram zat terlarut yang dilarutkan dalam 1000 gram pelarut. Satuan dari tonus molal adalah mol/kg. Dalam larutan, tonus molal dapat digunakan untuk menghitung osmosis, yaitu pergerakan zat terlarut di antara dua larutan yang dipisahkan oleh selaput semipermeabel.
Contoh soal:
Sebanyak 40 g gula (C12H22O11) dilarutkan dalam 1000 g air. Hitung tonus molal larutan tersebut.
Jawab:
Tonus molal = Jumlah gram zat terlarut / Berat pelarut (kg)
Molar massa gula (C12H22O11) = 12×12 + 1×22 + 11×16 = 342 g/mol
Mol gula = Massa / Molar massa = 40 g/342 g/mol = 0,117 mol
Tonus molal = 0,117 mol / (1000 g/1000) = 0,117 mol/kg
2. Penurunan Tekanan Uap
Penurunan tekanan uap adalah sifat larutan yang menyebabkan tekanan uapnya turun dibandingkan dengan tekanan uap pelarutnya murni. Sifat ini dipengaruhi oleh jumlah partikel zat terlarut di dalam larutan. Semakin banyak partikel zat terlarut dalam larutan, maka semakin besar pula penurunan tekanan uap yang terjadi.
Contoh soal:
Larutan hasil campuran 100 gram air dan 10 gram gula pasir (C12H22O11). Hitung penurunan tekanan uap larutan tersebut. Tekanan uap air murni pada 298 K sebesar 23,8 mmHg.
Jawab:
Tekanan uap air dalam larutan dapat dihitung menggunakan hukum Raoult:
p = xA.pA
Dimana:
p = Tekanan uap larutan
xA = Fraksi molar air (xA = 1 – xb)
pA = Tekanan uap air murni
xb = Fraksi molar zat terlarut
Fraksi mol gula (C12H22O11) = 10 g / 342 x 0,001 = 0,029 mol
Fraksi mol air = 1 – 0,029 = 0,971 mol
p = 0,971 x 23,8 mmHg = 23,1 mmHg
Penurunan tekanan uap adalah selisih antara tekanan uap air murni dengan tekanan uap pada larutan :
Δp = pA – p = 23,8 – 23,1 = 0,7 mmHg
3. Kenaikan Titik Didih
Kenaikan titik didih adalah sifat larutan yang menyebabkan titik didihnya naik dibandingkan dengan titik didih pelarutnya murni. Sifat ini juga dipengaruhi oleh jumlah partikel zat terlarut di dalam larutan. Semakin banyak partikel zat terlarut dalam larutan, maka semakin besar pula kenaikan titik didih yang terjadi.
Contoh soal:
Sebanyak 10 g gula (C12H22O11) dicampurkan dalam 100 g air. Hitung kenaikan titik didih air. (Kenaikan titik didih air murni = 0,52°C/m)
Jawab:
Kenaikan titik didih dapat dihitung menggunakan rumus:
ΔTb = Kb.𝝁2
Dimana:
ΔTb = Kenaikan titik didih
Kb = Konstanta kenaikan titik didih
𝝁2 = Molalitas larutan
Konstanta kenaikan titik didih air = 0,52°C/m
Molar massa gula (C12H22O11) = 12×12 + 1×22 + 11×16 = 342 g/mol
Mol gula = Massa / Molar massa = 10 g / 342 g/mol = 0,029 mol
Molalitas = Mol gula / Massa pelarut (kg) = 0,029 mol / 0,1 kg = 0,29 mol/kg
ΔTb = 0,52°C/m x 0,29 mol/kg = 0,15°C
Dalam pembahasan sifat koligatif ini, masih banyak sifat koligatif lainnya seperti tekanan osmosis dan volume molar. Namun, penjelasan tentang ketiga sifat koligatif tersebut di atas sudah dapat memberikan pemahaman yang cukup untuk memahami sifat koligatif pada larutan. Dengan memahami sifat koligatif ini, diharapkan dapat membantu pengukuran konsentrasi zat terlarut dalam larutan maupun memahami fenomena osmosis yang terjadi pada beberapa contoh sistem biologis.
Hukum Termodinamika
Hukum Termodinamika adalah serangkaian hukum yang mengatur interaksi antara energi dan materi. Ada tiga hukum termodinamika yang membahas perilaku sistem termodinamika. Hukum pertama menyatakan bahwa energi tidak bisa diciptakan atau dimusnahkan, tetapi hanya dapat diubah bentuknya. Sedangkan Hukum kedua mengatakan bahwa entropi suatu sistem akan selalu meningkat. Dan Hukum ketiga secara khusus membahas tentang suhu absolut dan bagaimana tekanan dan volume terkait dengannya.
Hukum pertama termodinamika juga dikenal sebagai Hukum Kekekalan Energi. Secara sederhana, hukum ini dapat diringkas sebagai “energi tidak bisa diciptakan atau dimusnahkan, hanya dapat diubah bentuknya.” Ini berarti bahwa jumlah total energi dalam sebuah sistem termodinamika akan selalu sama, meskipun energi dapat berubah bentuk dari satu bentuk ke bentuk lainnya. Contoh penerapannya adalah pada mesin kalor dan mesin listrik. Dalam mesin kalor, energi termal diambil dari bahan bakar dan diubah menjadi energi kinetik. Sedangkan dalam mesin listrik, energi kinetik digunakan untuk menghasilkan arus listrik.
Hukum kedua termodinamika menunjukkan bahwa total entropi sistem termal akan selalu meningkat. Ini berarti bahwa sistem yang tidak terganggu akan cenderung melawan perubahan termal, dan jika sistem termal terus menerima panas maka akhirnya akan mencapai setimbang termal. Hukum kedua juga menyatakan bahwa sistem termal tidak dapat mencapai suhu absolut nol. Suhu absolut nol adalah suhu terendah yang dapat dicapai, di mana tidak ada energi termal yang tersisa dalam sistem. Meski terdengar aneh, namun hukum kedua sangat penting dalam pemahaman teknologi pendingin dan memadukan teknologi pendingin dengan sistem energi.
Hukum ketiga termodinamika menyatakan bahwa tidak mungkin mencapai suhu absolut nol secara menyeluruh, tetapi hampir selalu memungkinkan untuk mencapainya dengan menggunakan mesin refrigerasi sebagai pendingin menggunakan bahan BakarFrid, yang memungkinkan tekanan dan volume terkait dengan suhu absolut. Suhu absolut nol adalah suhu paling rendah yang dapat dicapai oleh sistem termodinamika, sehingga noh persis sama dengan nol. Hukum ketiga juga memberikan hubungan antara entropi dan suhu ketika mencapai suhu absolut nol. Entropi suatu sistem akan mencapai nilai tertentu ketika suhu turun ke suhu absolut nol.
Secara keseluruhan, hukum termodinamika adalah pondasi penting dalam memahami interaksi energi dan materi. Meskipun terdengar kompleks, hukum termodinamika memberikan dasar untuk berbagai teknologi, mulai dari mesin kalor hingga teknologi pendingin modern. Oleh karena itu, dipelajari pada pelajaran Kimia kelas 12 Semester 1. Dengan memahami hukum termodinamika dan bagaimana mereka bekerja dalam praktiknya dapat membuka babak baru dalam pengembangan teknologi masa depan.
Kimia Organik dan Polimer
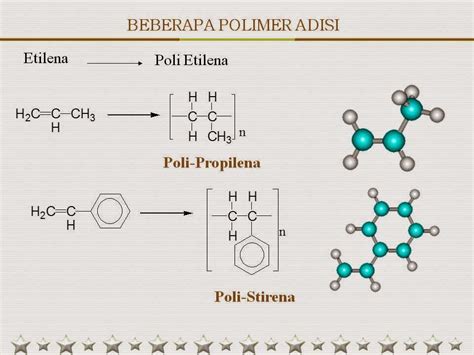
Kimia Organik adalah cabang ilmu Kimia yang mempelajari struktur, sifat, dan reaktivitas senyawa yang mengandung atom-atom karbon, sedangkan Polimer adalah senyawa organik panjang yang terdiri dari ikatan monomer. Soal kimia kelas 12 semester 1 tentunya akan banyak menguji pemahaman siswa terkait materi Kimia Organik dan Polimer. Contoh Soal Kimia Kelas 12 Semester 1 beserta jawabannya tentang Kimia Organik dan Polimer juga telah banyak tersedia untuk menambah pemahaman kita dalam bidang ini.
Berikut adalah contoh soal kimia organik dan polimer beserta jawabannya:
1. Apakah senyawa organik selalu mengandung unsur karbon?
Jawaban: Ya, Senyawa organik selalu mengandung unsur karbon.
2. Apa yang dimaksud dengan polimer?
Jawaban: Polimer adalah senyawa organik panjang yang terdiri dari ikatan monomer.
3. Apakah monomer memiliki berat molekul yang lebih rendah atau lebih tinggi dibandingkan dengan polimer?
Jawaban: Monomer memiliki berat molekul yang lebih rendah dibandingkan dengan polimer.
4. Bagaimana cara membuat senyawa polimer?
Jawaban: Cara membuat senyawa polimer dapat dilakukan melalui proses polimerisasi, yaitu reaksi yang mengubah monomer menjadi rantai polimer yang panjang.
Dalam polimerisasi, monomer digabungkan bersama-sama untuk membentuk polimer. Proses ini terjadi melalui beberapa tahapan, antara lain:
a. Inisiasi: Tahap awal reaksi di mana terjadi pelepasan radikal dari molekul tertentu.
b. Propagasi: Reaksi gabungan antara radikal dengan monomer, membentuk molekul radikal baru dan memberikan banyak sekali monomer yang terhubung ke dalam rantai polimer.
c. Terminasi: Tahap akhir reaksi di mana dua molekul radikal berdekatan, menghasilkan produk pertama dalam reaksi polimerisasi.
5. Apa itu senyawa organik alifatik?
Jawaban: Senyawa organik alifatik adalah senyawa organik yang mengandung rantai karbon atau cincin terbuka.
6. Apa yang dimaksud dengan senyawa organik aromatik?
Jawaban: Senyawa organik aromatik adalah senyawa organik yang mengandung cincin aromatik seperti benzena atau turunannya.
7. Apakah kelebihan dari senyawa polimer dibandingkan dengan senyawa monomer?
Jawaban: Senyawa polimer memiliki keuntungan karena memungkinkan untuk bahan yang lebih tahan lama dan lebih kuat secara struktural.
Kimia Organik dan Polimer merupakan materi yang sangat penting untuk dipelajari seiring dengan perkembangan zaman dan teknologi. Dalam contoh soal kimia kelas 12 semester 1, kita akan diuji pemahaman kita terkait dengan materi ini. Sehingga, penting bagi kita untuk memahami konten dan juga latihan soal yang telah ada untuk menambah pemahaman kita dalam bidang Kimia Organik dan Polimer ini.
Elektrokimia dan Sel Galvani
Elektrokimia dan Sel Galvani merupakan topik yang sangat penting dalam Pembelajaran pada Kelas 12 Semester 1 Kimia. Elektrokimia berkaitan dengan Reaksi Redoks dalam larutan elektrolit dan sel galvani adalah salah satu bentuk alat yang menghasilkan arus listrik. Dalam pembelajaran ini, Anda akan mempelajari tentang Elektrokimia dan Sel Galvani.
Elektrokimia
Elektrokimia adalah studi tentang Reaksi Redoks yang terjadi pada sel elektrokimia dan kaitannya dalam arus elektron. Reaksi Redoks terdiri dari dua proses yaitu oksidasi dan reduksi, yang terjadi secara bersamaan. Sel elektrokimia juga dikenal sebagai sel Volta dan dibuat dengan menempatkan dua elektroda yang terbuat dari bahan berbeda dalam elektrolit.
Reaksi redoks pada elektrokimia terjadi secara spontan, yaitu reaksi yang terjadi secara sendiri tanpa ada campur tangan dari luar. Untuk itu Elektrokimia dibagi menjadi dua jenis yaitu Sel Volta dan Sel Elektrolisis. Sel Volta menghasilkan arus listrik karena proses redoks. Sedangkan Sel Elektrolisis, akan menghasilkan senyawa baru jika diberikan arus searah, karena memiliki kemampuan membentuk senyawa dari ion-ion dalam larutan elektrolit.
Sel Galvani
Sel Galvani adalah salah satu alat yang menghasilkan arus listrik. Sel Galvani dibuat dengan menggunakan dua elektroda yang berbeda terbuat dari logam, dimasukkan ke dalam elektrolit. Selanjutnya, dua elektroda tersebut dihubungkan melalui kawat penghantar, dan kemudian aliran listrik dihasilkan.
Sel Galvani dirancang oleh ahli fisika Italia, Luigi Galvani. Sel tersebut terdiri dari dua elektroda berbeda, logam dan non-logam. Elektroda logam terdiri dari lebih dari satu jenis logam (misalnya tembaga dan seng). Yang satu di antaranya berfungsi sebagai katoda (yaitu elektroda positif) dan yang satu lagi sebagai anoda (yaitu elektroda negatif).
Sel Galvani memiliki banyak kegunaan dalam kehidupan sehari-hari, seperti pada bangunan listrik, baterai, dan industri elektronik. Selain itu, penemuan Sel Galvani juga membuka jalan bagi pengembangan alat yang menghasilkan listrik secara langsung seperti Lampu Kristal dan Generator Listrik.
Kesimpulan
Dalam Pembelajaran Kimia Kelas 12 Semester 1, Elektrokimia dan Sel Galvani adalah dua topik penting yang harus dipahami dengan baik. Elektrokimia membahas tentang Reaksi Redoks yang terjadi pada sel elektrokimia dan kaitannya dalam arus elektron. Sementara Sel Galvani merupakan salah satu alat yang menghasilkan arus listrik. Dalam kehidupan sehari-hari kita menggunakan banyak alat yang menggunakan prinsip Elektrokimia dan Sel Galvani, oleh karena itu mempelajari kedua topik tersebut sangatlah penting.






